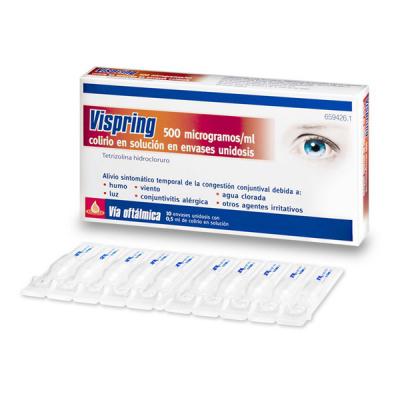
JOHNSON & JOHNSON - VISPRING 500 microgramos/ml COLIRIO (10 unidosis de 0,5ml)
VISPRING 500 microgramos/ml COLIRIO EN SOLUCION EN ENVASE UNIDOSIS del laboratorio Johnson And Johnson, S.A.
Principio activo: TETRIZOLINA HIDROCLORURO
Excipientes: BORATO SODICO (BORAX),CLORURO DE SODIO
Lea todo el prospecto detenidamente porque contiene información importante para usted.
Este medicamento puede adquirirse sin receta. No obstante, para obtener los mejores resultados, debe utilizarse con cuidado.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si necesita consejo o más información, consulte a su farmacéutico.
- Si los síntomas empeoran o persisten después de 48 horas debe consultar al médico.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1. Qué es Vispring en envases unidosis y para qué se utiliza. 2. Antes de usar Vispring en envases unidosis.
3. Cómo usar Vispring en envases unidosis
. 4. Posibles efectos adversos.
5. Conservación de Vispring en envases unidosis.
6. Información adicional.
1. Qué es Vispring en envases unidosis y para qué se utiliza
Pertenece al grupo de los medicamentos denominados descongestivos para uso oftalmológico que actúan produciendo descongestión ocular.
Está indicado para el alivio sintomático temporal de la congestión conjuntival debida a: humo, viento, agua clorada, luz, conjuntivitis alérgica y otros agentes irritativos.
2. Antes de usar Vispring en envases unidosis.
No use Vispring en envases unidosis si:
Es alérgico (hipersensible) a la tetrizolina o a cualquiera de los demás componentes de este medicamento.
Tiene presión intraocular aumentada (glaucoma de ángulo estrecho).
Padece enfermedades del corazón o tiene la tensión arterial alta (hipertensión).
Tiene un tumor en las glándulas adrenales (feocromocitoma)- su médico se lo indicará.
Tiene la glándula tiroides hiperactiva (hipertiroidismo).
Tiene diabetes controlada con insulina.
Está en tratamiento con antidepresivos de la clase de los inhibidores de la amino-oxidasa u otros medicamentos elevadores de la presión sanguínea.
Tiene rinitis seca.
Tiene inflamada la cornea y la membrana conjuntiva ocular (queratoconjuntivitis).
En niños menores de 2 años.
Tenga especial cuidado con Vispring en envases unidosis
 Si tiene dolor ocular intenso, dolor de cabeza, cambios rápidos en la visión, aparición rápida de manchas flotantes, enrojecimiento agudo del ojo, dolor tras la exposición a la luz o visión doble. Si esto le sucediera debe consultar al médico.
Si es mayor de 65 años. Uso de otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente cualquier otro medicamento, incluso los adquiridos sin receta médica, homeopáticos, plantas medicinales y otros productos relacionados con la salud, y en particular, si está utilizando alguno de los siguientes medicamentos, ya que puede ser necesario modificar la dosis de alguno de ellos: Medicamentos antidepresivos inhibidores de la amino-oxidasa
Medicamentos antidepresivos tricíclicos.
Medicamentos elevadores de la presión sanguínea.
Informe a su médico o farmacéutico si está tomando o ha tomado recientemente cualquier otro medicamento.
Si utiliza cualquier otro producto por vía oftálmica se recomienda dejar pasar al menos 5 minutos entre ambas administraciones.
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
Vispring en envases unidosis tiene escasa o ninguna influencia en la capacidad para conducir y utilizar maquinaria. En raras ocasiones, la capacidad de conducir y utilizar máquinas puede verse alterada debido a una visión borrosa o por deslumbramiento.
3. Cómo usar Vispring en envases unidosis.
Siga exactamente las instrucciones de administración de Vispring en envases unidosis a menos que su médico le haya dado otras indicaciones distintas. Consulte a su médico o farmacéutico si tiene dudas.
Este medicamento se administra por vía oftálmica.
La dosis normal es de 1 ó 2 gotas en cada ojo dos o tres veces al día.
La cantidad de Vispring en envases unidosis es suficiente para un único uso en ambos ojos. Una vez separado un envase unidosis de la tira, y retirado el dispositivo de cierre, aplicar las gotas en el ojo presionando ligeramente el envase.
Deseche el envase después de cada uso.
Debe ser utilizado únicamente para irritaciones oculares menores. Si no obtiene alivio en 48 horas o si el enrojecimiento aumenta o persiste, interrumpa su uso y consulte con su médico. Se ha de utilizar tan solo hasta que desparezcan los síntomas y nunca durante más de una semana. Si usa más Vispring en envases unidosis del que debiera El uso excesivo o la ingestión oral pueden dar lugar a la depresión del sistema nervioso central.
Existe riesgo especialmente en neonatos y niños, por absorción del producto, por ejemplo debido a ingestión.
Los síntomas asociados a la sobredosis son dilatación de la pupila del ojo, coloración azulada de piel y mucosas, náuseas, fiebre, calambres, alteración del ritmo cardíaco, parada cardiaca, aumento de la tensión arterial, edema pulmonar, alteraciones respiratorias y mentales. Si ha usado más Vispring en envases unidosis de lo que se debe, consulte inmediatamente a su médico o farmacéutico o bien llame al Servicio de Información Toxicológica, teléfono 91.562.04.20, indicando el medicamento y la cantidad utilizada.
Si olvidó usar Vispring en envases unidosis
No use una dosis doble para compensar las dosis olvidadas.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Vispring en envases unidosis puede tener efectos adversos, aunque no todas las personas lo sufran.
Poco frecuentes (al menos 1 de cada 1.000 pacientes): quemazón en la mucosa ocular, sequedad ocular, enrojecimiento de rebote (hiperemia), palpitaciones, dolor de cabeza, temblor, debilidad, sudoración y aumento de la presión sanguínea.
Raros (al menos 1 de cada 10.000 pacientes): visión borrosa, irritación de la conjuntiva ocular y dilatación de la pupila (midriasis).
El uso prolongado y frecuente puede producir síndrome de ojo seco.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5. Conservación de Vispring en envases unidosis.
No conservar a temperatura superior a 25oC. Mantener fuera del alcance y de la vista de los niños.
No utilice Vispring en envases unidosis después de la fecha de caducidad que aparece en la caja. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto Sigre de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Información adicional.
Composición de Vispring en envases unidosis
- Cada ml contiene 500 microgramos de tetrizolina hidrocloruro como principio activo.
- Los demás componentes (excipientes) son: Ácido bórico (E-284), borato de sodio, cloruro de sodio y agua purificada.
Vispring en envases unidosis es un colirio en solución claro e incoloro que se presenta en envases unidosis de 0,5 ml. Cada caja contiene 10 envases.
Titular de la autorización de comercialización
JOHNSON & JOHNSON S.A. Paseo de las Doce Estrellas, 5-7 28042-Madrid
Responsable de la fabricación LABORATOIRE UNITHER Zi de la Guérie Coutances Cedex Francia
Este prospecto ha sido aprobado en junio de 2007
* Web del fabricante/laboratorio: JOHNSON & JOHNSON
Si quiere leer el prospecto de este medicamento pinche en este enlace
Para consultar la ficha técnica de este medicamento pinche en este enlace
Click aquí para acceder al Centro de Información online de Medicamentos de la Agencia Española de Medicamentos y Productos Sanitarios.